最新トピックス
Biophysical Journalに公募班・大阪大学・荒田敏昭氏の論文が掲載されました 論文
Biophysical Journalに公募班・大阪大学・荒田敏昭氏の論文が掲載されました。
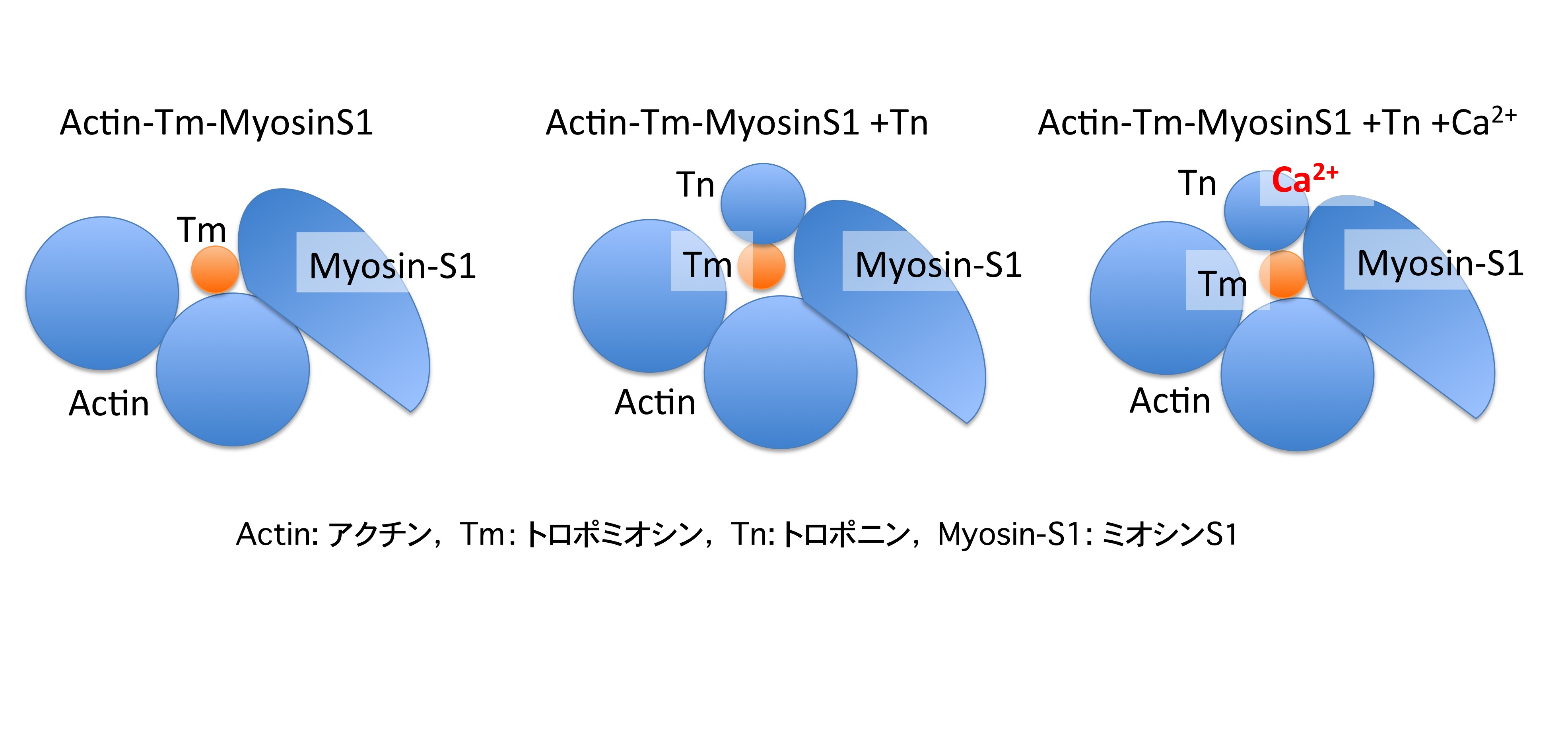
『ミオシンを結合した細いフィラメントのトロポミオシン接触構造はカルシウムイオンの結合で変化する』
カルシウムスイッチマシナリー「筋肉の細いフィラメント」の7個のアクチンあたり1個あるトロポニンへカルシウムイオンが結合することによって、トロポニンの大きな構造変化に引きずられて、棒状のトロポミオシンが動いて、個のアクチン全部にミオシンが相互作用できるようになるという仮説があるが、その実体は謎である。SDSL-ESR法では,タンパク質の変異システインにスピンラベル(SL)標識して電子スピン共鳴(ESR)分光することにより、分子間相互作用によって立体障害をうけ、SL側鎖運動性が低下する部位を特定することができる。われわれは、トロポミオシンをコイルドコイルの全長にわたって10箇所のアミノ酸をシステインに変異させてSL標識し、トロポニン、アクチンとともに、筋肉の細いフィラメントを再構成した。以前の我々の研究では、SL側鎖運動性はカルシウムイオンによって全く変化しないので、「トロポミオシンが動く」という単純な仮説に修正を迫るものである。今回、トロポニン非存在下でアクチンとトロポミオシンで再構成し、ミオシン頭部S1を結合させアクトミオシン硬直複合体を形成させたところ、SL側鎖運動性は著しく低下し、トロポミオシン接触面はミオシンとの結合によりタイトな構造になっていることが示唆され、最近の電顕観察を強く支持した。さらにトロポニンを加えて再構成したところ、SL側鎖運動性は増大し接触面が少し緩むことがわかった。次に、カルシウムイオンを添加したところ、SL側鎖運動性は再び低下しトロポニン非存在下のそれに近づいた。アクトミオシン硬直複合体におけるこのようなトロポミオシン接触構造のカルシウムイオンによる変化から、「強く結合したアクトミオシン複合体のATP加水分解反応が、この構造変化を通してカルシウム調節される」という新しい仮説を提案することができる。この仮説は、低イオン強度下ではカルシウムイオン非存在下においても強く結合したアクトミオシン複合体が形成され張力を発生するが、そのATP加水分解反応や短縮速度が著しく低いことを説明することができる。